Lokalisation der Sprache im Gehirn
Bildgebende Verfahren
Elektrophysiologische und hämodynamische Verfahren
Die wichtigsten funktionell bildgebenden Verfahren lassen sich in zwei große Klassen einteilen: Elektrophysiologische und hämodynamische Verfahren. Elektrophysiologische Verfahren messen relativ direkt die Aktivität von Nervenzellen, d.h. Auslöser des Messsignals sind tatsächlich Aktionspotentiale, also das physiologische Korrelat neuronaler Aktivität. Hämodynamische Verfahren machen sich dagegen einen sekundären Effekt neuronaler Aktivität zunutze, nämlich den erhöhten Stoffwechselumsatz aktiver Nervenzellen. Die wichtigsten Verfahren im Überblick:
Elektrophysiologische Verfahren:
- Elektroenzephalographie (EEG)/Ereigniskorrelierte Potentiale (EKP) (Event-Related Potentials, ERP)
- Magnetoenzephalographie (MEG)
Hämodynamische Verfahren:
- Positronenemissionstomographie (PET)
- Funktionelle Magnetresonanztomographie (fMRT) bzw. funktionelle Kernspintomographie (fKST) (functional Magnetic Resonance Imaging, fMRI)
- Single Photon Emission Computed Tomography (SPECT)
- Optical Imaging bzw. Near Infrared Spectroscopy (NIRs)
Generell gilt nach wie vor, dass elektrophysiologische Verfahren eine sehr gute Zeitauflösung aber eine schlechte räumliche Aufösung haben, während hämodynamische Verfahren eine sehr gute räumliche Auflösung aber eine schlechte Zeitaufösung haben. Infolge technischer Entwicklungen werden die jeweiligen Nachteile jedoch immer kleiner. So kann mittlerweile z.B. bei MEGs der räumliche Ursprung des Signals schon recht genau berechnet werden, während die fMRT andererseits stetig in der Zeitauflösung aufholt. Wenn aber die funktionelle Lokalisation im Vordergrund steht, eignen sich PET und fMRT immer noch deutlich besser als EEG und MEG. Geht es dagegen um die Untersuchung der Dynamik der Hirnaktivität, sind EEG und MEG die besseren Verfahren. Vielversprechend, aber aufgrund der aufwändigen Technik noch relativ selten, sind kombinierte Verfahren, z.B. EEG+fMRT.
Im Rahmen der Erforschung der menschlichen Sprachfähigkeit spielen elektrophysiologische Methoden vor allem bei der Untersuchung psycholinguistischer Fragestellungen eine wichtige Rolle. Die Methoden sind sehr gut geeignet, um beispielsweise Sprachverarbeitungsmodelle zu evaluieren, die Aktivierungsreihenfolge verschiedener Verarbeitungsmodule zu bestimmen (insbesondere bei der Sprachwahrnehmung, weniger gut bei der Sprachproduktion) oder inkrementelle vs. parallele Verarbeitungsstrategien zu differenzieren. Da es in diesem Kapitel aber um die Lokalisation der Sprache im Gehirn gehen soll, werden im weiteren Verlauf die zwei wichtigsten hämodynamischen Verfahren im Mittelpunkt stehen.
PET und fMRT
Die größten Fortschritte hinsichtlich der Lokalisation kognitiver Funktionen wie z.B. der Sprachfähigkeit verdanken wir PET- und fMRT-Studien. Die fMRT steht seit Anfang der 1990er Jahre zur Verfügung, PET ist etwas älter. Neben der funktionellen Kartierung des menschlichen Gehirns, dem Ansatz der hier im Mittelpunkt stehen soll, eigenen sich beide Methoden auch für andere Untersuchungsansätze, die im folgenden kurz erwähnt werden sollen.
- PET ist ein anerkanntes klinisch-diagnostisches Verfahren z.B. im Bereich der Onkologie oder der Kardiologie.
- PET eignet sich auch sehr gut für neurophysiologische und neurochemische Untersuchungen, z.B. zum Nachweis der Aktivität von Dopamin-Rezeptoren.
- Mit PET lässt sich Stoffwechselaktivität im Gehirn natürlich auch unabhängig von funktionellen Fragestellungen untersuchen.
- Sowohl PET als auch fMRT können für Studien eingesetzt werden, bei denen der Ansatz der funktionellen Intergation im Mittelpunkt steht. Während die funktionelle Kartierung die Grundannahme des Läsion-Defizit-Ansatzes teilt, dass spezifische, klar abgegrenzte Hirnregionen für spezifische kognitive Funktionen spezialisiert sind (functional segregation), steht bei der funktionellen Integration die Konnektivität zwischen verschiedenen Hirnarealen im Zentrum des Interesses. Hinter diesem Ansatz steht die Annahme, dass kognitive Funktionen nicht (bzw. nicht nur) einzelnen spezialisierten Arealen zuzuschreiben sind, sondern entscheidend auf der Interaktion zwischen Arealen beruht.
Bevor wir nun zu den unterschiedlichen Messprinzipien der beiden Verfahren kommen, soll zunächst noch einmal auf eine grundlegende Gemeinsamkeit von PET und fMRT hingewiesen werden. Wie bereits erwähnt wird bei beiden Verfahren neuronale Aktivität über den Umweg eines sekundären physiologischen Phänomens detektiert, welches jedoch in einem eindeutigen ursächlichen Zusammenhang mit Zellaktivität steht. Zur Aufrechterhaltung eines Aktionspotentials benötigen Nervenzellen mehr Nährstoffe als im Ruhezustand, d.h. im Bereich aktiver Neuronen kommt es zu einer Steigerung des Stoffwechselumsatzes (metabolism rate). Um diesen erhöhten Nährstoffbedarf zu gewährleisten, reagiert der Organismus, indem er den Blutfluss in dieser Region erhöht und damit mehr sauerstoffangereichertes Blut Oxyhämoglobin) anliefert. Genau diese Veränderung des regionalen Blutflusses (regional Cerebral Blood Flow, rCBF) wird von den beiden Verfahren — auf unterschiedliche Art und Weise — gemessen und dient als Indikator für neuronale Aktivität.
Das Messprinzip der PET
Bei einer PET-Untersuchung wird die Verteilung einer zuvor verabreichten, radioaktiv markierten Substanz (Tracer) im Organismus dargestellt. Es kommen verschiedene dieser Substanzen zum Einsatz, bei der funktionellen Untersuchung des Gehirns handelt es sich meist um Sauerstoff-Isotope. Der markierte Sauerstoff kann vom Organismus nicht von gewöhnlichem Sauerstoff unterschieden werden und geht somit in den normalen Stoffwechsel ein, d.h. in Regionen mit erhöhtem Stoffwechselumsatz und infolge dessen erhöhtem rCBF reichert sich mehr radioaktiver Sauerstoff an als anderswo. Beim Zerfall der Sauerstoff-Isotope entstehen Positronen, die nach der Reaktion mit einem Elektron eine Gammastrahlung verursachen. Diese Gammastrahlung wird vom PET-Scanner detektiert und ihr Ausgangspunkt kann aufgrund nuklearphysikalischer Prinzipien lokalisiert werden. Somit können letztendlich Areale, die eine erhöhte Gammastrahlung verursachen (aktivierte Areale) von Arealen mit geringer Strahlung (nicht-aktivierte Areale) unterschieden werden.
Der BOLD-Effekt: Die physiologische Basis der fMRT
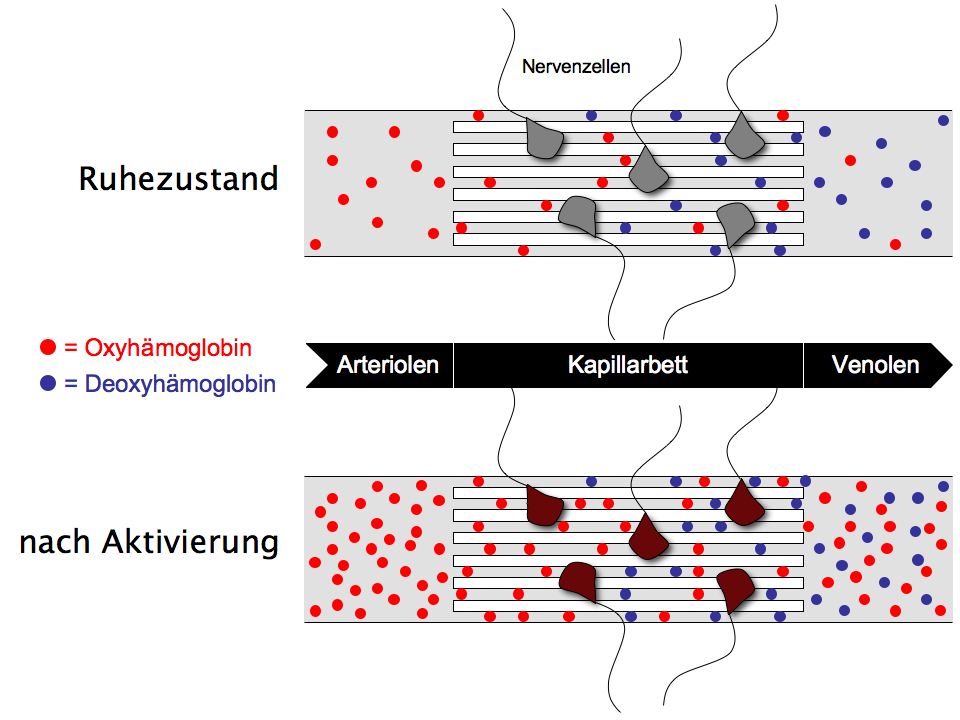

Die Erkennung von rCBF-Veränderungen basiert bei der Kernspintomographie nicht auf radioaktiver Strahlung sondern auf einem Magnetresonanzeffekt (daher auch die Bezeichnung Magnetresonanztomographie), der als unbedenklich für den menschlichen Organismus gilt (ein großer Vorteil gegenüber PET). Um das Messprinzip der fMRT besser verstehen zu können, müssen zunächst die physiologischen Vorgänge im Zusammenhang mit der rCBF-Zunahme etwas detaillierter erläutert werden. Wie oben beschrieben, reagiert der Organismus auf die Steigerung des Stoffwechselumsatzes im Bereich aktiver Neuronen mit einer rCBF-Zunahme, um mehr Oxyhämoglobin anzuliefern. Das Verhalten des Organismus gleicht dabei jedoch einer Überreaktion, d.h. es wird mehr Oxyhämoglobin angeliefert, als die aktiven Nervenzellen tatsächlich verbrauchen. Dies hat zur Folge, dass es im venösen Bereich des Kapillarbettes, in dem normalerweise verbrauchtes Blut', also Deoxyhämoglobin überwiegt, im Umfeld von aktiven Nervenzellen kurzzeitig zu einer Anreicherung mit Oxyhämoglobin kommt. Da Oxyhämoglobin (diamagnetisch) und Deoxyhämoglobin (paramagnetisch) unterschiedliche magnetische Eigenschaften aufweisen, hat die Veränderung des Anteils von Oxyhämoglobin im venösen Blut eine Veränderung der lokalen magnetischen Feldinhomogenität zur Folge, welche wiederum durch den fMRT-Scanner detektiert werden kann. Die Veränderung des fMRT-Signals hängt also vom Grad der Sauerstoffanreicherung im Blut ab, daher wird der der fMRT-Messung zugrundeliegende Effekt als Blood Oxygenation Level Dependent bzw. BOLD-Effekt bezeichnet.
Magnetresonanz: Das Messprinzip der fMRT
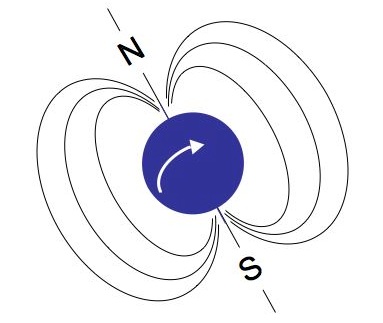

Atomkerne mit einer ungeraden Anzahl an Protonen verfügen über einen sogenannten Kernspin, d.h. sie drehen sich um ihre eigene Achse. Der im menschlichen Organsimus häufigste und zugleich einfachste Atomkern mit einer ungeraden Anzahl an Protonen — nämlich genau einem Proton — ist der Wasserstoffkern (H+). Durch die Drehung des positiv geladenen Wasserstoffkerns (die blaue Kugel in der nebenstehenden Abbildung) wird ein (sehr schwaches!) Magnetfeld erzeugt; man spricht in diesem Fall von einem Dipol. Das Prinzip ist vergleichbar mit der Erddrehung. Durch die Rotation der Erdkugel entsteht ebenfalls ein Magnetfeld, die Austrittspunkte der gedachten Achse entsprechen den beiden Polen.
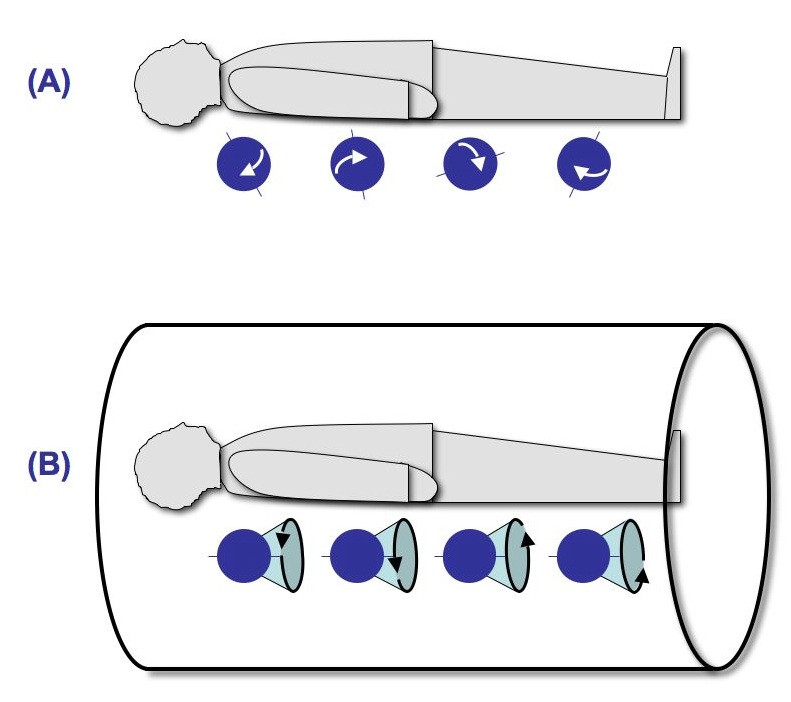

Die Ausrichtung der Drehachsen der Wasserstoffkerne ist normalerweise zufällig verteilt (Zustand A in der Abbildung), so dass sich in der Summe die Magnetfelder (genauer: die magnetischen Momente) gegenseitig aufheben. Setzt man die Wasserstoffkerne jedoch einem starken statischen Magnetfeld aus, wie es z.B. innerhalb eines MR-Scanners herrscht, so passieren zwei Dinge (Zustand B in der Abbildung):
Erstens richtet sich ein gewisser Prozentsatz der im Körper befindlichen Wasserstoffkerne parallel zum Magnetfeld des Scanners aus, d.h. die Drehachsen der ausgerichteten Kerne weisen alle in eine Richtung. In diesem Zustand ist die sogenannte Längs- oder Longitudinalmagnetisierung der ausgerichteten Kerne relativ zum statischen Magnetfeld des Scanners maximal. Wie hoch der Prozentsatz der ausgerichteten Wasserstoffkerne ist, hängt von der Stärke des statischen Magnetfeldes ab. Am weitesten verbreitet (Stand 2007) sind Geräte mit einer Feldstärke von 1,5 Tesla (T), neuere Scanner verfügen über 3 T und mehr (1,5 T entsprechen etwa der 15.000-fachen Stärke des Erdmagnetfeldes). Wie weiter unter deutlich wird, wird das Verhältnis zwischen Nutzsignal und Grundrauschen (Signal-to-Noise Ratio) besser je mehr Wasserstoffkerne ausgerichtet sind, d.h. mit der Feldstärke des Scanners steigt die Messqualität (aber natürlich auch die Kosten und z.B. die Lärmbelastung während der Messung).
Zweitens wird eine zusätzliche Bewegungskomponente induziert, die sogenannte Präzession. Während der Kernspin eine Eigendrehung des Atomkerns beschreibt, handelt es sich bei der Präzession um eine Rotation der gedachten Drehachse des Atomkerns eine Art 'Torkeln'). Die Geschwindigkeit der Rotation — die Präzessionsfrequenz — hängt ebenfalls von der Stärke des statischen Magnetfeldes ab; bei 1,5 T beträgt die Präzessionsfrequenz etwa 64 Mhz. Wie in der nebenstehenden Abbildung (B, schwarze Pfeile) angedeutet, präzedieren die Wasserstoffkerne asynchron, d.h. ihr magnetisches Moment hebt sich auf und die Quer- oder Transversalmagnetisierung der Kerne ist in diesem Zustand minimal.
Der Ausgangszustand im Scanner (Zeitpunkt B in den Abbildungen) kann also wie folgt zusammengefasst werden: Einige Wasserstoffkerne im Organismus des Probanden sind parallel zum Magnetfeld des Scanners ausgerichtet, gleichzeitig präzedieren diese Kerne, und zwar asynchron. Die Longitudinalmagnetisierung dieser Kerne ist maximal, die Transversalmagnetisierung ist minimal.


Für die MR-Messung (sowohl strukturell als auch funktionell) wird nun dieser Ausgangszustand verändert, indem ein hochfrequenter elektromagnetischer Impuls (radio-frequency- oder rf-pulse) eingestrahlt wird. Entspricht die Impulsfrequenz der Resonanzfrequenz der präzedierenden Wasserstoffkerne, so führt dies erstens dazu, dass die Kerne in Phase, d.h. synchron präzedieren, und zweitens, dass die Ausrichtung einiger Drehachsen in eine relativ zum statischen Magnetfeld antiparallele Lage 'geflipt' wird (Zeitpunkt C in der Abbildung). Abhängig von der Dauer und der Amplitude des rf-Impulses werden unterschiedlich viele Kerne geflipt; sind genau die Hälfte der ausgerichteten Kerne betroffen bei einem sogenannten 90°-Impuls), so heben sich die längsmagnetischen Momente gegenseitig auf und die Longitudinalmagnetisierung reduziert sich auf Null. Aufgrund der synchronen Präzession entsteht zugleich ein quermagnetisches Moment, d.h. die Transversalmagnetisierung erreicht einen Maximalwert.
Nach Abklingen des rf-Impulses fällt das System in den Ausgangszustand zurück; dies wird als Relaxation bezeichnet. Entsprechend den oben beschriebenen Effekten lassen sich zwei Arten der Relaxation unterscheiden: Die geflipten Kerne schwingen aus der antiparallelen in die parallele Lage zurück (Longitudinalrelaxation; D in der Abbildung) und die synchronisierte Präzession zerfällt, d.h. die Kerne präzedieren wieder asynchron (Transversalrelaxation; D' in der Abbildung). Während dieser Relaxationen wird elektromagnetische Energie frei, die vom MR-Scanner detektiert und lokalisiert werden kann. Interessant für die Bildgebung ist nun, dass erstens beide Relaxationsarten relativ unabhängig voneinander gemessen werden können, und dass zweitens unterschiedliche Parameter die Geschwindigkeit der Relaxation einzelner Wasserstoffkerne beeinflussen:
Longitudinalrelaxation


Die Geschwindigkeit der Longitudinalrelaxation eines Wasserstoffkerns ist im wesentlichen abhängig vom Gewebetyp in dem sich der Kern befindet. So schwingen beispielsweise Wasserstoffkerne in der Umgebung von Fettgewebe relativ schnell zurück in die parallele Lage (Zeitpunkt D, Bereich 1), während Wasserstoffkerne im Liquor relativ langsam zurückschwingen (Zeitpunkt D, Bereich 3). Der Zeitpunkt, zu dem das Gesamtsystem 63% seiner ursprünglichen Längsmagnetisierung wieder erreicht hat, heißt T1; daher auch die Bezeichnung T1-Relaxation. Wird nun die Messsequenz des Scanners so gewählt, dass vorallem elektromagnetische Strahlung detektiert wird, die im Zusammenhang mit der T1-Relaxation abstrahlt, so erhält man eine strukturelle (T1-gewichtete) Aufnahme: Der Bildkontrast, also die Hell-Dunkel-Abstufung, ist abhängig vom Gewebetyp. Gewebe mit schneller T1-Zeit, wie z.B. Fett, wird heller dargestellt, da die ursprüngliche Längsmagnetisierung fast wiederhergestellt ist. Gewebe mit langsamer T1-Zeit, wie z.B. Liquor, wird dunkler dargestellt, da die Längsmagnetisierung noch nahe Null liegt.
Transversalrelaxation
Die Transversalrelaxation, also die Dephasierung der Präzession, wird von zwei Parametern beeinflusst: Zum einen wieder vom Gewebetyp (T2-Relaxation), zum anderen aber auch von lokalen Magnetfeldinhomogenitäten (T2*-Relaxation), wobei die T2*-Relaxation schneller ist und die T2-Relaxation überlagert. Je nach gewählter Messsequenz können T2- oder T2*-gewichtete Aufnahmen angefertigt werden. T2-gewichtete Aufnahmen setzten zudem eine komplexere Anregung voraus: Durch einen zweiten, um 180° versetzten rf-Impuls wird ein sogenanntes Spin-Echo erzeugt, um lokale Magnetfeldinhomogenitäten zu neutralisieren (die sonst den T2-Effekt überlagern würden). Da T2 vom Gewebetyp abhängt, erhält man auch hier wie bei T1-gewichteten Bildern strukturelle Aufnahmen, allerdings mit umgekehrter Graustufenkodierung: Fettgewebe stellt sich nun dunkel dar, Liquor hell.
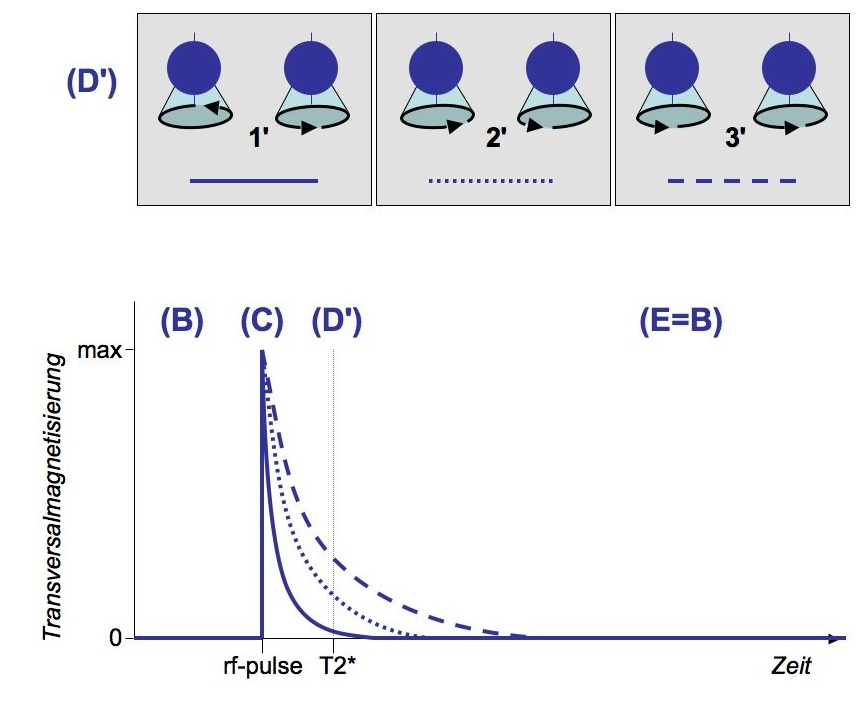

Die funktionelle MRT setzt dagegen auf T2*-gewichtete Aufnahmen. Wie oben beschreiben, führt der Überschuss an Oxyhämoglobin im venösen Bereich des Kapillarbettes im Umfeld aktiver Neuronen zu einer Steigerung der lokalen Magnetfeldinhomogenität im Vergleich zum Ruhezustand mit einem höheren Anteil an Deoxyhämoglobin (s. BOLD-Effekt). Da nun die Geschwindigkeit der T2*-Relaxation genau von solchen lokalen Magnetfeldinhomogenitäten abhängt, können mit einer entsprechend gewichteten Messung Aufnahmen erstellt werden, die diesen Kontrast darstellen. Die T2*-Konstante bezeichnet die Zeit, nach der das Gesamtsystem 67% seiner Quermagnetisierung wieder verloren hat. Wie gesagt, verläuft der Zerfall der synchronen Präzession jedoch unterschiedlich schnell, abhängig davon, ob sich ein Wasserstoffkern in einem mehr oder weniger homogenen lokalen Magnetfeld befindet. In der Abbildung ist zum Zeitpunkt D' die Dephasierung im Bereich 1' am weitesten fortgeschritten, das magnetische Moment und damit die elektromagnetische Abstrahlung aus diesem Bereich ist gering. Im Bereich 3' präzedieren die Kerne dagenen noch fast synchron, was entsprechend zu einer stärkeren Abstrahlung führt.
Diese Unterschiede sind zwar messbar, aber sehr klein, so dass sie bei einer einzelnen Aufnahme vom Grundrauschen des Systems überdeckt würden. Verbessern lässt sich dieses schlechte Signal-Rausch-Verhältnis (Signal-to-Noise Ratio) insbesondere dadurch, dass mehr Wasserstoffkerne angeregt werden und in die Messung eingehen. Voraussetzung dafür ist ein höherer Prozentsatz alinierter Kerne durch eine Anhebung der magnetischen Feldstärke des Scanners. Alternativ dazu bietet sich die heute übliche Möglichkeit, mehrere Aufnahmen bei gleicher Aufgabenstellung anzufertigen und die aufgabenkorrelierte Signalvariation mithilfe statistischer Methoden vom Grundrauschen zu isolieren.
Beispiele: fMRT-Studien zur Sprachproduktion
Lautes Sprechen und inneres Sprechen
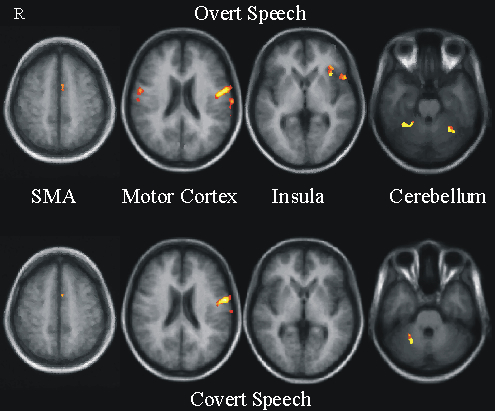
Auch beim sogenannten inneren Sprechen (covert speech, d.h. die Versuchspersonen stellen sich nur vor zu sprechen, ohne es tatsächlich zu tun) sind typische sprechmotorische Areale aktiv: Supplementär-motorisches Areal (SMA), Motorkortex und Zerebellum. Im Gegensatz zum tatsächlichen Sprechen (overt speech) zeigen sich jedoch nur unilaterale Aktivierungen. Die anteriore Inselregion (Insula) zeigt sich nur beim tatsächlichen Sprechen aktiviert.
Rhythmisches Sprechen
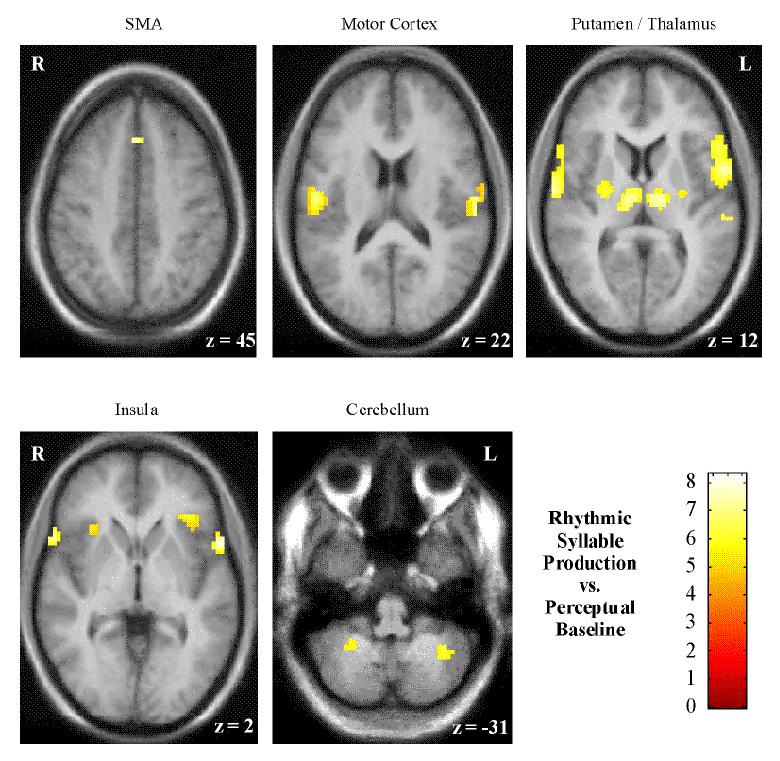
Bei der dezidiert rhythmischen Rezitation von Silbensequenzen zeigt sich zusätzlich zu den erwarteten Aktivierungen in der SMA, Motorkortex, Insel und Zerebellum eine bilaterale subkortikale Aktivierung im Putamen und Thalamus.
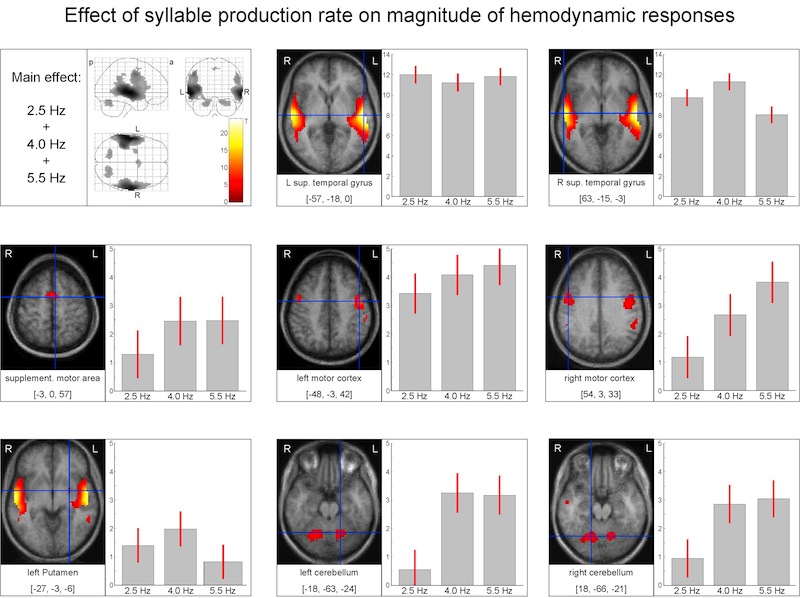
Sprechgeschwindigkeit
Die Abbildung zeigt Aktivierungsunterschiede in verschiedenen Hirnregionen abhängig davon, mit welcher Sprechgeschwindigkeit die Versuchspersonen eine Silbensequenz produzierten (langsam: 2,5 Silben/Sek., normal: 4 Silben/Sek., schnell: 5,5 Silben/Sek.). Ähnliche Muster zeigen sich im Zerebellum und in der SMA: geringe Aktivierung bei langsamer Sprechgeschwindigkeit, gleich starke Aktivierung bei normaler und schneller Sprechgeschwindigkeit. Im linken Putamen nimmt dagegen die Aktivierung mit zunehmender Sprechgeschwindigkeit ab. Im rechten Motorkortex nimmt die Aktivierung schrittweise mit zunehmender Sprechgeschwindigkeit zu.
Plastizität
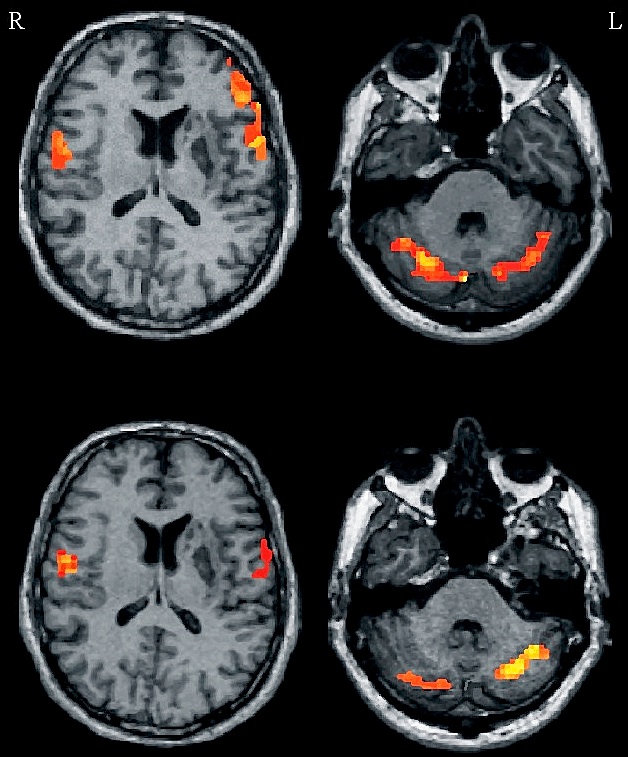
Nach einem Insult in der linken Capsula interna und anfangs schwerer Dysarthrie hat sich bei diesem Patienten die sprechmotorische Kontrolle nach wenigen Tagen in die rechte Hemisphäre verlagert. Die Dysarthrie hat sich daraufhin komplett zurück gebildet. Oben: Aufnahme 4 Tage nach Ereignis; links-dominante Aktivierung im Motorkortex und (gekreuzte) rechts-dominante Aktivierung im Kleinhirn. Unten: Aufnahme 35 Tage nach Ereignis; rechts-dominante Aktivierung im Motorkortex und links-dominante Aktivierung im Kleinhirn.
Prosodie
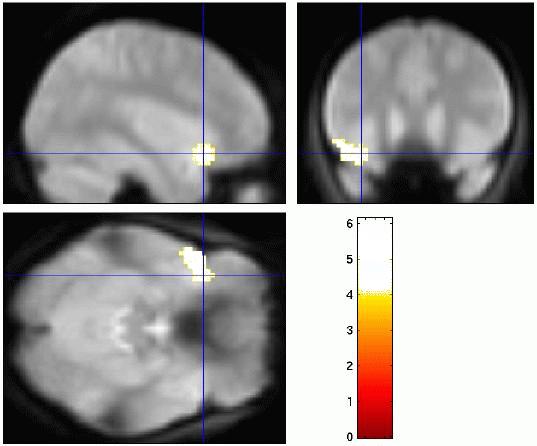
Linguistische Prosodie I: Akzent
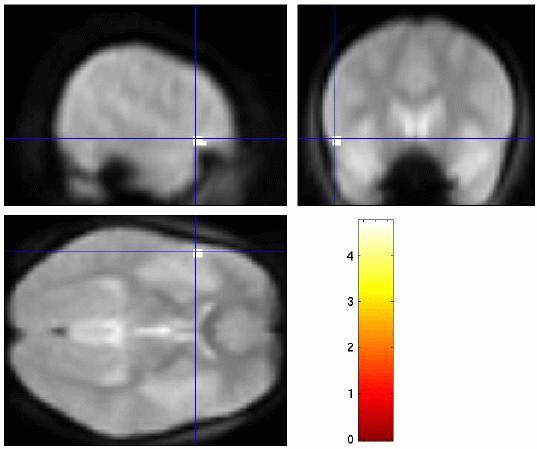
Linguistische Prosodie II: Grenzton
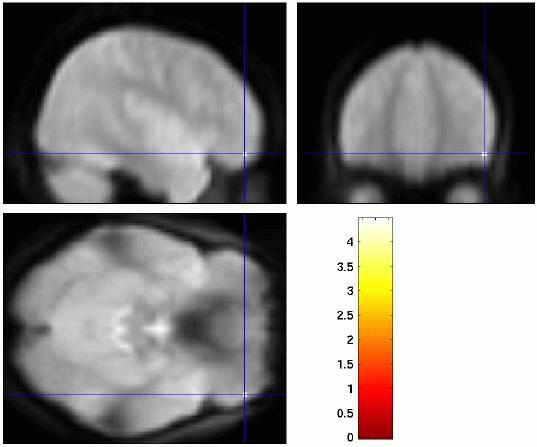
Affektive Prosodie / Emotion
Vergleich zwischen linguistischer Prosodie (links: Variation der Akzentposition; mitte: Variation des Phrasengrenztons) und affektiver Prosodie (rechts: Variation der affektiven Färbung, fröhlich/traurig) in der Sprachproduktion. Es zeigt sich jeweils Aktivierung im frontalen Operkulum, allerdings unterschiedlich lateralisiert: linguistische Parameter werden in der linken Hemisphäre verarbeitet, affektive Parameter dagegen in der rechten Hemisphäre.